Les probiotiques : Des bases solides dès la naissance
On parle beaucoup de probiotiques ces jours-ci, et pour cause. Il a été démontré que ces bactéries incroyables combattent les infections, diminuent l’inflammation, améliorent l’humeur, purifient la peau, et aident dans le traitement des problèmes cardiovasculaires. Effectivement, elles peuvent faire tout cela ! J’aimerais ici attirer votre attention sur deux bactéries uniques et très importantes : B. infantis et L. reuteri.
 B. infantis
B. infantis
Dès le début de la vie, Bifidobacterium longum ssp. Infantis — oui, son nom complet est assez long — est abondant chez les bébés allaités. À la naissance, lors de notre passage dans le canal vaginal, nous sommes très largement inoculés de bactéries. Ensuite, l’allaitement continue à fournir chaque jour un microbiote unique composé de millions de bactéries amies [1]. Le lait maternel est un « super jus magique » impossible à recréer. Il contient non seulement tous les nutriments dont un bébé a besoin, mais également des bactéries bénéfiques ainsi que des fibres glucidiques appelées oligosaccharides. Les humains sont incapables de digérer ces oligosaccharides [2], mais B. infantis le peut, et c’est le seul probiotique capable de digérer la gamme complète des oligosaccharides contenus dans le lait maternel. Par conséquent, il a un avantage majeur sur les autres bactéries [3], et cela l’aide à se développer en abondance pour constituer environ 80 à 90 % du microbiote d’un bébé [4], [5]. Les bifidobactéries en général, et B. infantis en particulier, fermentent les oligosaccharides du lait et produisent des acides gras à chaîne courte (AGCC), tels que l’acétate et le butyrate. Les AGCC nourrissent les cellules des intestins, fournissent des nutriments au bébé en pleine croissance, et combattent les agents pathogènes. B. infantis est donc une bactérie fondamentale qui colonise l’intestin et qui favorise la croissance d’autres bactéries amies.
Les nourrissons prématurés qui ont reçu un supplément de B. infantis ont montré une augmentation de B. infantis, comme prévu, mais aussi de l’ensemble des bifidobactéries au sein de leur microflore. Cela indique que B. infantis favorise la colonisation de l’ensemble des bifidobactéries [6]. Les bifidobactéries semblent coopérer pour décomposer les glucides complexes en sucres simples. Elles agissent ensemble en tant que communauté [7], afin de rendre disponibles plus de nutriments — dans ce cas des sucres simples — pour d’autres bactéries intestinales.
Un autre rôle important de B. infantis est le renforcement de la paroi intestinale. Les bébés ont relativement plus d’espaces entre leurs cellules intestinales, et donc une plus grande perméabilité de la muqueuse intestinale favorable à la pénétration d’agents pathogènes dans la lymphe et le sang. B. infantis signale aux cellules intestinales de produire certaines protéines pour renforcer la paroi intestinale en comblant ces lacunes, et réduire ainsi la perméabilité [8]. En outre, B. infantis produit du folate (vitamine B9), qui est vital dans la production de globules rouges et le transport de l’oxygène vers les tissus, en plus de jouer un rôle majeur dans la synthèse et la réparation de l’ADN [9].
B. infantis est précieux à tous les âges, car il possède cette incroyable capacité à réparer la paroi intestinale et à réduire l’inflammation, une propriété bienvenue dans des conditions telle que la colite ulcéreuse [10], [11]. Il joue également un rôle majeur dans le développement et le fonctionnement du système immunitaire. La prise de B. infantis après l’utilisation d’antibiotiques ou après une coloscopie peut favoriser une restauration saine du microbiote. Chez les enfants nés par césarienne, la supplémentation en B. infantis est une approche sûre pour établir un microbiote intestinal plus sain, car B. infantis fait partie des premières souches à coloniser l’intestin du nourrisson [12].
 L. reuteri
L. reuteri
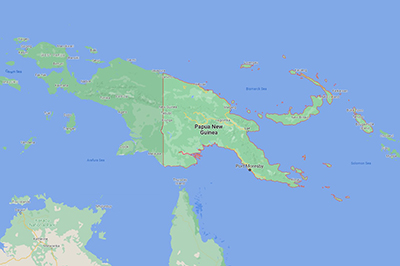
Lactobacillus reuteri est l’une de nos bactéries les plus étudiées et a été isolée pour la première fois en 1962 [13]. Son nom émane du microbiologiste allemand Gerhard Reuter [14]. Durant les premières recherches, elle a été régulièrement trouvée dans le tractus digestif humain, et chez les mêmes sujets à plusieurs reprises. Les études concluaient alors qu’il s’agissait d’un membre stable du microbiote humain [15]. Curieusement, les recherches actuelles montrent que L. reuteri semble être absent de nos voies digestives. En comparant des sujets de Papouasie–Nouvelle-Guinée rurale à d’autres sujets des États-Unis, L. reuteri a été trouvé dans le tube digestif de toutes les personnes de Papouasie–Nouvelle-Guinée rurale, mais d’aucune du groupe étatsunien [16].
Cette diminution évidente de l’abondance de L. reuteri au cours des dernières décennies est « corrélée à une augmentation de l’incidence des maladies inflammatoires sur la même période » [17]. On a émis l’hypothèse que cette « disparition » de L. reuteri pourrait être liée à des changements alimentaires, à l’utilisation de médicaments, et à des pratiques d’assainissement [18].
 Pourtant, L. reuteri est bien coriace. Comme d’autres bactéries formant de l’acide lactique, elle a tendance à coloniser le tractus gastro-intestinal supérieur, en particulier l’intestin grêle, et elle semble être plus résistante que les autres souches. Elle produit des molécules antimicrobiennes, qui inhibent la colonisation des microbes pathogènes (mauvaises bactéries, virus, champignons, et parasites), stimulant ainsi l’établissement d’un microbiote sain dans les intestins. L. reuteri peut également bénéficier grandement à notre système immunitaire, notamment en réduisant la production de cytokines inflammatoires et en favorisant la sécrétion de cellules T régulatrices [19]. Cet équilibre est bénéfique dans les conditions allergiques, où le système immunitaire a tendance à réagir de manière excessive. Tout comme B. infantis, L. reuteri est excellent pour protéger la fonction barrière de la muqueuse. Elle peut diminuer la perméabilité intestinale en renforçant les espaces entre les cellules épithéliales grâce à l’augmentation des protéines spécifiques aux jonctions serrées [20]. De nombreuses maladies inflammatoires sont liées à cette hyperperméabilité intestinale et au passage de macromolécules et de microbes à travers la muqueuse, mettant ainsi en alerte constante le système immunitaire. L. reuteri aide à améliorer l’intégrité de la muqueuse intestinale et donc à prévenir les maladies inflammatoires tant au niveau intestinal que dans les tissus éloignés [21].
Pourtant, L. reuteri est bien coriace. Comme d’autres bactéries formant de l’acide lactique, elle a tendance à coloniser le tractus gastro-intestinal supérieur, en particulier l’intestin grêle, et elle semble être plus résistante que les autres souches. Elle produit des molécules antimicrobiennes, qui inhibent la colonisation des microbes pathogènes (mauvaises bactéries, virus, champignons, et parasites), stimulant ainsi l’établissement d’un microbiote sain dans les intestins. L. reuteri peut également bénéficier grandement à notre système immunitaire, notamment en réduisant la production de cytokines inflammatoires et en favorisant la sécrétion de cellules T régulatrices [19]. Cet équilibre est bénéfique dans les conditions allergiques, où le système immunitaire a tendance à réagir de manière excessive. Tout comme B. infantis, L. reuteri est excellent pour protéger la fonction barrière de la muqueuse. Elle peut diminuer la perméabilité intestinale en renforçant les espaces entre les cellules épithéliales grâce à l’augmentation des protéines spécifiques aux jonctions serrées [20]. De nombreuses maladies inflammatoires sont liées à cette hyperperméabilité intestinale et au passage de macromolécules et de microbes à travers la muqueuse, mettant ainsi en alerte constante le système immunitaire. L. reuteri aide à améliorer l’intégrité de la muqueuse intestinale et donc à prévenir les maladies inflammatoires tant au niveau intestinal que dans les tissus éloignés [21].
Conclusion
Pour résumer, B. infantis et L. reuteri pourraient prévenir les infections et améliorer la réponse immunitaire en cas d’allergies ou d’asthme par exemple. Ces deux souches doivent également être considérées lors de maladies inflammatoires telles que la colite ulcéreuse et d’autres affections intestinales comme le syndrome du côlon irritable [22]. Toute personne ayant des problèmes au niveau de la muqueuse intestinale, telle que l’hyperperméabilité, pourrait également en bénéficier. Par exemple, B. infantis et L. reuteri aident à lutter contre les affections cutanées atopiques telles que l’eczéma et le psoriasis à tous les âges. L. reuteri peut aider dans les coliques infantiles et en cas d’infection à H. pylori, E. coli, et d’autres infections [23]. Les mères qui allaitent peuvent envisager d’ajouter B. infantis à leur alimentation quotidienne ou de le donner directement aux bébés (étalé sur le mamelon lors de l’allaitement ou mélangé au lait maternisé), même aux prématurés [24].
 B. infantis et L. reuteri doivent tous deux être conservés à basse température, alors assurez-vous de les acheter chez des détaillants qui les conservent au réfrigérateur, et assurez-vous qu’ils restent réfrigérés à la maison. Recherchez des capsules à enrobage entérique, afin que votre acide gastrique ne tue pas ces souches fragiles, et qu’elles arrivent en toute sécurité dans vos intestins. De cette façon, vous vous assurez qu’elles peuvent faire toutes les choses merveilleuses dont elles sont capables.
B. infantis et L. reuteri doivent tous deux être conservés à basse température, alors assurez-vous de les acheter chez des détaillants qui les conservent au réfrigérateur, et assurez-vous qu’ils restent réfrigérés à la maison. Recherchez des capsules à enrobage entérique, afin que votre acide gastrique ne tue pas ces souches fragiles, et qu’elles arrivent en toute sécurité dans vos intestins. De cette façon, vous vous assurez qu’elles peuvent faire toutes les choses merveilleuses dont elles sont capables.
 Krista Mackay, BSc, ND
Krista Mackay, BSc, ND
Krista pratique à Montréal, Québec, et à Montevideo, Uruguay. Mère de deux garçons, elle se concentre sur la médecine naturopathique générale et familiale. Elle aide ses patients à trouver un équilibre raisonnable pour un bien-être optimal par le biais de la gestion du stress, de la nutrition, de la phytothérapie, et du travail corps-esprit.
kristamackay.ca
[1] Lyons, K.E., et autres. « Breast milk, a source of beneficial microbes and associated benefits for infant health. » Nutrients, Vol. 12, N° 4 (2020): 1039.
[2] Lyons et autres. « Breast milk, a source of beneficial microbes. »
[3] Nguyen, M., et autres. « Impact of probiotic B. infantis EVC001 feeding in premature infants on the gut microbiome, nosocomially acquired antibiotic resistance, and enteric inflammation. » Frontiers in Pediatrics, Vol. 9 (2021): 618009.
[4] Nguyen et autres, « Impact of probiotic B. infantis EVC001. »
[5] Wilkinson, T.S. « Immunity to bacteria infections. » Chapitre 8 de la Section 2 (p. 408–428) dans : Rezaei, N., éd. Encyclopedia of Infection and Immunity, Amsterdam, Elsevier, 2022, 3428 p., ISBN 978-0-12-818731-9.
[6] Nguyen et autres, « Impact of probiotic B. infantis EVC001. »
[7] O’Callaghan, A., et D. van Sinderen. « Bifidobacteria and their role as members of the human gut microbiota. » Frontiers in Microbiology, Vol. 7 (2016): 925.
[8] Ewaschuk, J.A., et autres. « Secreted bioactive factors from Bifidobacterium infantis enhance epithelial cell barrier function. » American Journal of Physiology: Gastrointestinal and Liver Physiology, Vol. 295, N° 5 (2008): G1025–G1034.
[9] Rossi, M., A. Amaretti, et S. Raimondi. « Folate production by probiotic bacteria. » Nutrients, Vol. 3, N° 1 (2011): 118–134.
[10] Zuo, L., et autres. « Bifidobacterium infantis attenuates colitis by regulating T cell subset responses. » World Journal of Gastroenterology, Vol. 20, N° 48 (2014): 18316-18329.
[11] Han, T., et autres. « Bifidobactarium infantis maintains genome stability in ulcerative colitis via regulating anaphase-promoting complex subunit 7. » Frontiers in Microbiology, Vol. 12 (2021): 761113.
[12] Duar, R.M., D. Kyle, et R.M. Tribe. « Reintroducing B. infantis to the cesarean-born neonate: An ecologically sound alternative to “vaginal seeding”. » FEMS Microbiol Letters, Vol. 367, N° 6 (2020): fnaa032.
[13] Mu, Q., V.J. Tavella, et X.M. Luo. « Role of Lactobacillus reuteri in human health and diseases. » Frontiers in Microbiology, Vol. 9 (2018): 757.
[14] Britton, R.A. “Lactobacillus reuteri. » Chapitre 8 (p. 89–97) dans Floch, M.H., Y. Ringel, et W.A. Walker, éds. The Microbiota in Gastrointestinal Pathophysiology. London, Academic Press, 2017, 419 p., ISBN 978-0-12-804024-9.
[15] Walter, J., R.A. Britton, et S. Roos. « Host-microbial symbiosis in the vertebrate gastrointestinal tract and the Lactobacillus reuteri paradigm. » Proceedings of the National Academy of Sciences of the United States of America, Vol. 108, Suppl. 1 (2011): 4645–4652.
[16] [Anonyme.] « Rewilding the human gut: Reintroduction of the species Lactobacillus reuteri. » ClinicalTrials.gov. Updated 2020-05-05. Identifier: NCT03501082.
[17] Mu et autres, « Role of Lactobacillus reuteri in human health and diseases. »
[18] « Rewilding the human gut. » op. cit.
[19] Mu et autres, « Role of Lactobacillus reuteri in human health and diseases. »
[20] Mu et autres, « Role of Lactobacillus reuteri in human health and diseases. »
[21] Mu et autres, « Role of Lactobacillus reuteri in human health and diseases. »
[22] Zuo et autres, « Bifidobacterium infantis attenuates colitis. »
[23] Walter et autres, « Host-microbial symbiosis. »
[24] Nguyen et autres, « Impact of probiotic B. infantis EVC001. »

 Magasins
Magasins
